Registro Sanitario de Medicamentos en México
En México y todos los países desarrollados, el registro sanitario de medicamentos es un trámite obligado para las empresas que los fabrican. Así que es importante conocer como realizar el trámite, su duración y las herramientas técnicas que te ayudarán a facilitarlo.
Algo de Historia de la Industria farmacéutica en México
La aparición de la industria farmacéutica en México significó un proceso complejo en el que incidieron diversos factores tanto nacionales como internacionales. La industrialización farmacéutica había surgido en Europa en el transcurso del siglo XIX, sin embargo en México los avances de la química no habían generado aún el interés por crear una industria de producción de drogas y medicamentos. Fue en las últimas décadas del siglo XIX, que hicieron su aparición en México la medicina de patente y la especialidad farmacéutica. Sería hasta después de la Revolución Mexicana en 1917, cuando se establecen en México, empresas dedicadas a la producción, importación y/o comercialización masiva de medicamentos con capitales sólidos. En 1926 el Departamento de Salubridad Pública decretó un nuevo código sanitario y en 1927 implementó el primer Registro Sanitario en la historia de la nación.
Requisitos para registrar un medicamento en México
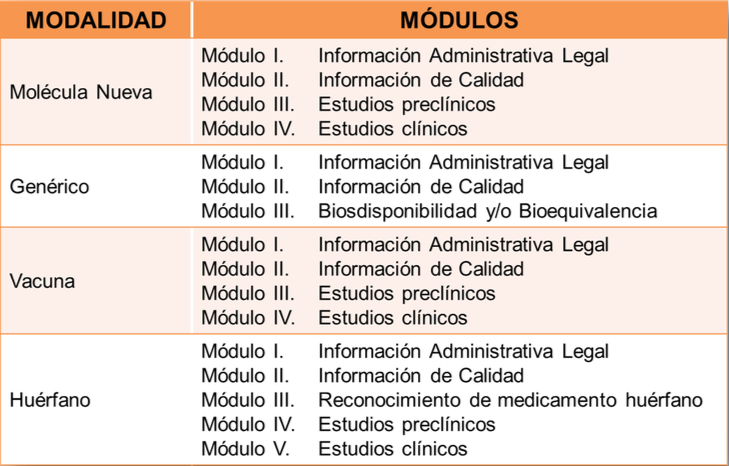
Los requisitos para registrar un medicamento son extensos. En la siguiente imagen se presenta una síntesis de las secciones o módulos que debe considerar el expediente para registrar un medicamento cuando este es una molécula nueva, genérico, vacuna o huérfano.
Pero si deseas conocer todos los requisitos detallados para realizar el registro puedes revisar la página de la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris).
¿Cuanto tarda la COFEPRIS para liberar el registro de un medicamento?
Hasta hace poco mas de un año, la cofepris se tardaba alrededor de 30 meses en la revisión de expedientes para el registro de medicamentos. Sin embargo, el año pasado, con la aprobación de terceros autorizados para realizar dicha revisión, este trámite se ha agilizado mucho, reduciendo el tiempo de espera a sólo 4 meses. Si el expediente cumple con los requisitos establecidos, el medicamento queda liberado para su venta.
Modificaciones a las condiciones de registro sanitario de medicamentos
Una vez que se consigue que el registro sanitario de un medicamento sea aprobado por la Cofepris es probable, que a lo largo del tiempo se deseen hacer algunos ajustes. Por ejemplo, una reducción a la cantidad de análisis microbiológicos realizados a una tableta, un escalamiento para hacer lotes de medicamento más grandes porque la demanda ha aumentado, aumentar el plazo de la caducidad que haya otorgado el agente regulador, cambios de envase primario o cambio en la forma farmacéutica, cambio del fabricante del ingrediente activo principal, etc. Pero si se presenta cualquiera de los eventos citados, será necesario realizar una modificación a las condiciones del registro sanitario. Cualquiera de estos cambios debe ir acompañado con un Estudio de Estabilidad perfectamente planeado, ejecutado y sustentado estadísticamente.
Herramientas para registrar medicamentos
Debido a que el tiempo que se utiliza para todo este proceso es largo y repetitivo, lo mejor será que tengas las herramientas que te permitan ejecutar todo este proceso de manera eficiente. En Grupo Desisa nos dedicamos a desarrollar herramientas informáticas para la industria farmacéutica que te faciliten este tipo de tareas. Un ejemplo de ello es el sistema EESys® que es un software que administra los estudios de estabilidad y además proporciona herramientas estadísticas de importancia para el sustento del estudio de estabilidad y, por ende, en el proceso de conseguir un registro sanitario o una modificación a las condiciones de registro.
Una respuesta a “Registro Sanitario de Medicamentos en México”
Deja un comentario
Temas
- Aseguramiento de Calidad (3)
- Dispositivos Médicos (3)
- DMSys (2)
- EESys (8)
- Estudios de Estabilidad de Medicamentos (20)
- Grupo DESISA (1)
- Industria Farmacéutica en México (10)
- Mantenimiento del Estado Validado (1)
- RAPSys (11)
- Revisión Anual de Producto (30)
- Sistemas Computarizados en la Farmacéutica (6)
- Validación de Sistemas Computarizados (5)
- Verificación continua del Proceso (6)


. Cómo podrías acortar los tiempos regulatorios (obtención de registro y de acceso (lograr acceso en todas las instituciones a la vez ) para los nuevos lanzamientos