7 Errores Comunes en Estudios de Estabilidad y Cómo los Sistemas Informáticos Pueden Prevenirlos

En la industria farmacéutica, los estudios de estabilidad son fundamentales para garantizar la seguridad y eficacia de los productos farmacéuticos a lo largo de su vida útil. Sin embargo, la gestión manual de estos estudios puede conducir a errores significativos que afectan la integridad de los datos y, en última instancia, la conformidad regulatoria. A continuación, exploramos los errores más comunes encontrados en las auditorías de estudios de estabilidad y cómo la implementación de sistemas informáticos puede ayudar a prevenirlos.
Identificación de OOT en Estudios de Estabilidad: Método del Intervalo de Predicción
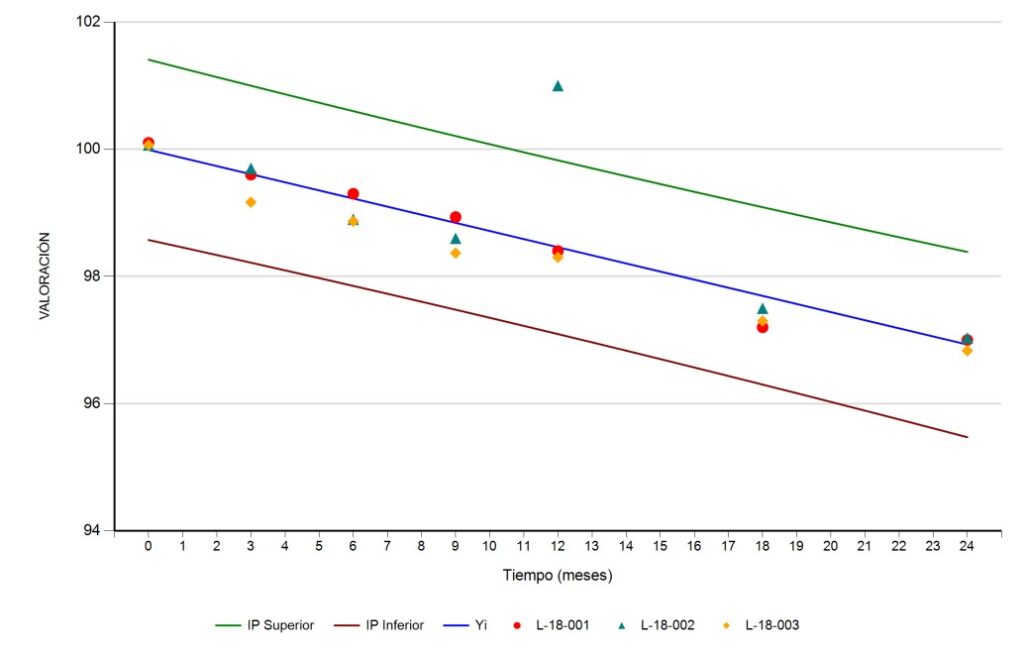
En el competitivo campo de la farmacéutica, la identificación precisa de resultados fuera de tendencia (OOT) en estudios de estabilidad farmacéutica es esencial para la seguridad y eficacia de los medicamentos. El método del intervalo de predicción emerge como una herramienta estadística destacada, combinando precisión y efectividad.
Evitando No Conformidades en Salida de Muestras

Los estudios de estabilidad son un componente crucial en la industria farmacéutica, asegurándose de que los productos mantengan su eficacia y seguridad durante su vida útil. Uno de los aspectos más significativos de estos estudios implica la salida de muestras de las cámaras climáticas. Este proceso puede ser complejo y, sin el seguimiento adecuado, puede resultar en observaciones durante las auditorías. Pero, ¿cómo se puede simplificar este proceso y minimizar el riesgo de no conformidades? La respuesta puede estar en las notificaciones automáticas de un software adecuado.
Análisis de tendencias, cruciales en los estudios de estabilidad
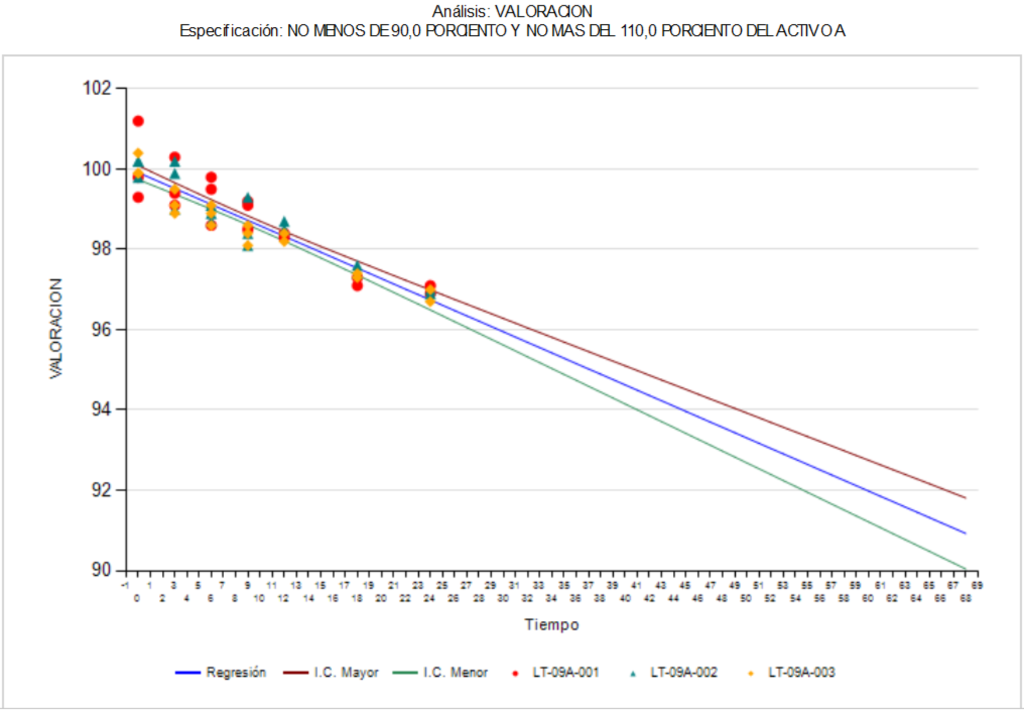
En la industria farmacéutica, el estudio de estabilidad de medicamentos es un proceso esencial para asegurar la calidad, seguridad y eficacia de los productos farmacéuticos. Los estudios de estabilidad se realizan para evaluar cómo cambia la calidad de los medicamentos con el tiempo, en diferentes condiciones de almacenamiento y transporte. Sin embargo, en la actualidad, la importancia de realizar análisis de tendencias en los estudios de estabilidad de medicamentos está tomando cada vez más relevancia, sobre todo para las agencias regulatorias.
Sistematización de los Estudios de Estabilidad y Mejora Continua

Hoy en día es de suma importancia llevar a cabo un control adecuado de los estudios de estabilidad, ya que las entidades regulatorias establecen criterios a cumplir según las normas de cada país e internacionalmente según lo dicta la ICH. La interrogante aquí sería ¿La empresa farmacéutica donde trabaja está cumpliendo con estos criterios?
Cálculos para periodo de reanálisis o vida útil de fármacos y medicamentos

El objetivo de un estudio de estabilidad es conocer que tan estable se mantiene un medicamento en condiciones ambientales definidas, con base en el análisis de mínimo tres lotes del fármaco o medicamento. Por otro lado, también establecer con fundamento estadístico un período de reanálisis o de vida útil, así como conocer las condiciones de almacenamiento indicadas en la etiqueta que aplicarán a los lotes futuros fabricados y envasados en circunstancias similares.
¿Porqué sistematizar los estudios de estabilidad?

Primordialmente, el fabricante de fármacos y/o medicamentos, está obligado a garantizar la calidad, la eficacia y la inocuidad a lo largo de toda la vida útil del producto, con el objetivo de ofrecer al consumidor un producto seguro, y eficaz.
El sistematizar el registro de los estudios de estabilidad, garantiza de manera puntual el documentar los cambios que experimentan las características físico-químicas y microbiológicas del producto.
Combinabilidad de los datos en estudios de estabilidad (Poolability)
Uno de los objetivos del análisis estadístico en los estudios de estabilidad es evaluar si el periodo de reanálisis o vida útil estimado es más largo que el propuesto. Saber si podemos o no combinar los datos de los lotes en la estadística es de vital importancia.
Desviaciones Comunes en Estudios de Estabilidad de Medicamentos
oca
Las desviaciones más comunes en los estudios de estabilidad de medicamentos pueden evitarse utilizando las herramientas adecuadas. Hay desviaciones desde el punto de vista analítico como: incumplimiento de las especificaciones establecidas, material de envase incompatible, fallos en las cámaras climáticas. También existen otras desviaciones administrativas menos severas pero que de igual forma impactan a los estudios de estabilidad
¿Como estimar el periodo de caducidad de medicamentos?
Sin duda alguna, existen varios métodos estadísticos que son de gran utilidad para estimar el periodo de caducidad de un medicamento. En este artículo analizaremos métodos para estudios de estabilidad a largo plazo y a corto plazo.
Temas
- Aseguramiento de Calidad (3)
- Dispositivos Médicos (3)
- DMSys (2)
- EESys (7)
- Estudios de Estabilidad de Medicamentos (13)
- Grupo DESISA (1)
- Industria Farmacéutica en México (10)
- Mantenimiento del Estado Validado (1)
- RAPSys (10)
- Revisión Anual de Producto (24)
- Sistemas Computarizados en la Farmacéutica (6)
- Validación de Sistemas Computarizados (5)
- Verificación continua del Proceso (6)



