7 Errores Comunes en Estudios de Estabilidad y Cómo los Sistemas Informáticos Pueden Prevenirlos

En la industria farmacéutica, los estudios de estabilidad son fundamentales para garantizar la seguridad y eficacia de los productos farmacéuticos a lo largo de su vida útil. Sin embargo, la gestión manual de estos estudios puede conducir a errores significativos que afectan la integridad de los datos y, en última instancia, la conformidad regulatoria. A continuación, exploramos los errores más comunes encontrados en las auditorías de estudios de estabilidad y cómo la implementación de sistemas informáticos puede ayudar a prevenirlos.
Identificación de OOT en Estudios de Estabilidad: Método del Intervalo de Predicción
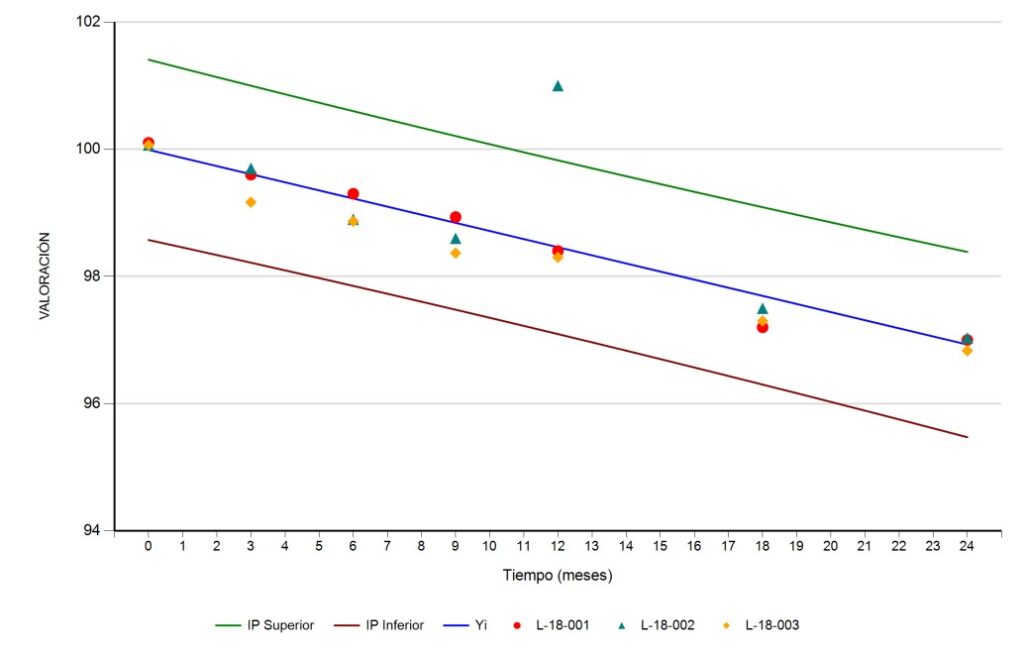
En el competitivo campo de la farmacéutica, la identificación precisa de resultados fuera de tendencia (OOT) en estudios de estabilidad farmacéutica es esencial para la seguridad y eficacia de los medicamentos. El método del intervalo de predicción emerge como una herramienta estadística destacada, combinando precisión y efectividad.
Evitando No Conformidades en Salida de Muestras

Los estudios de estabilidad son un componente crucial en la industria farmacéutica, asegurándose de que los productos mantengan su eficacia y seguridad durante su vida útil. Uno de los aspectos más significativos de estos estudios implica la salida de muestras de las cámaras climáticas. Este proceso puede ser complejo y, sin el seguimiento adecuado, puede resultar en observaciones durante las auditorías. Pero, ¿cómo se puede simplificar este proceso y minimizar el riesgo de no conformidades? La respuesta puede estar en las notificaciones automáticas de un software adecuado.
Análisis de Tendencia en los Estudios de Estabilidad
En la actualidad el uso de la estadística en los estudios de estabilidad se ha convertido en una herramienta fundamental e imprescindible para obtener el conocimiento de las cinéticas de degradación, para definir la caducidad o periodo de validez y analizar resultados y sus tendencias, cabe mencionar que para las agencias regulatorias como la FDA entre otras han realizado en diversos establecimientos observaciones como oportunidad de mejora “Realizar análisis de tendencia utilizando herramientas estadísticas”.
Sistematización de los Estudios de Estabilidad y Mejora Continua

Hoy en día es de suma importancia llevar a cabo un control adecuado de los estudios de estabilidad, ya que las entidades regulatorias establecen criterios a cumplir según las normas de cada país e internacionalmente según lo dicta la ICH. La interrogante aquí sería ¿La empresa farmacéutica donde trabaja está cumpliendo con estos criterios?
Cálculos para periodo de reanálisis o vida útil de fármacos y medicamentos
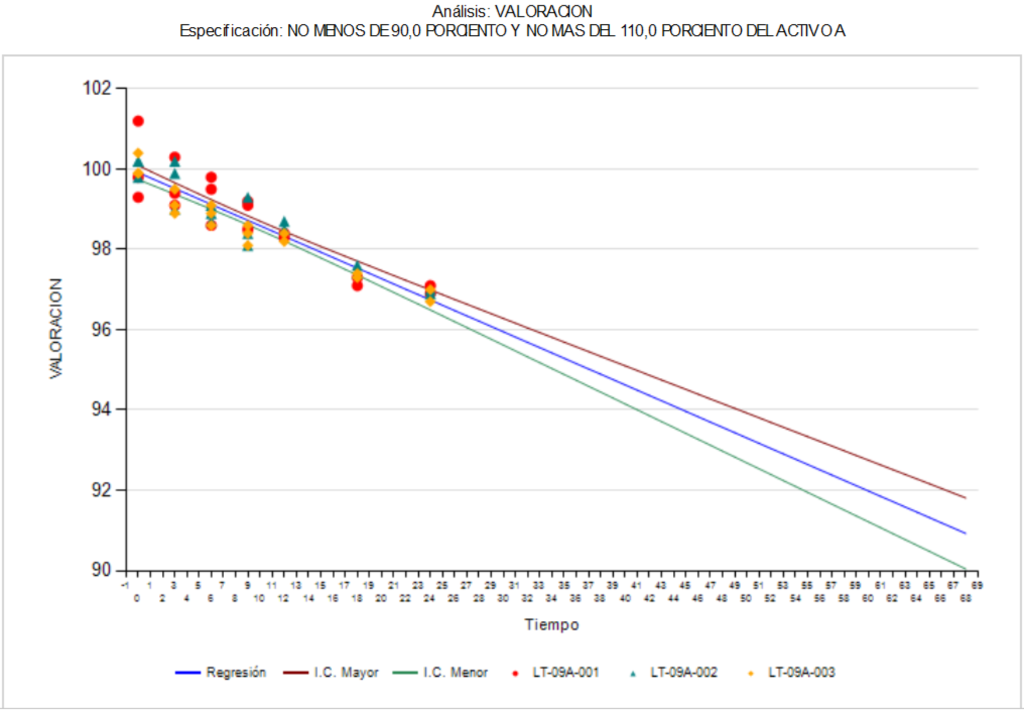
El objetivo de un estudio de estabilidad es conocer que tan estable se mantiene un medicamento en condiciones ambientales definidas, con base en el análisis de mínimo tres lotes del fármaco o medicamento. Por otro lado, también establecer con fundamento estadístico un período de reanálisis o de vida útil, así como conocer las condiciones de almacenamiento indicadas en la etiqueta que aplicarán a los lotes futuros fabricados y envasados en circunstancias similares.
EESys© V2 ahora funciona con SQL Server
Debido a la necesidad de crecimiento y al impulso de mejora que los clientes de la industria farmacéutica requieren, ahora el sistema EESys© V2 puede almacenar la información en una base de datos más robusta, la base de datos de Microsoft® SQL Server.
Lanzamiento EESys© V2 para los Estudios de Estabilidad
Hoy jueves 11 de julio de 2019 nos complace informar sobre el lanzamiento del nuevo sistema EESys© V2 un software para la administración, control y estadística de los estudios de estabilidad, en la industria farmacéutica y farmoquímica. Es una versión completamente mejorada en tecnología y funcionalidades.
Desviaciones Comunes en Estudios de Estabilidad de Medicamentos
oca
Las desviaciones más comunes en los estudios de estabilidad de medicamentos pueden evitarse utilizando las herramientas adecuadas. Hay desviaciones desde el punto de vista analítico como: incumplimiento de las especificaciones establecidas, material de envase incompatible, fallos en las cámaras climáticas. También existen otras desviaciones administrativas menos severas pero que de igual forma impactan a los estudios de estabilidad
¿Como estimar el periodo de caducidad de medicamentos?
Sin duda alguna, existen varios métodos estadísticos que son de gran utilidad para estimar el periodo de caducidad de un medicamento. En este artículo analizaremos métodos para estudios de estabilidad a largo plazo y a corto plazo.
Temas
- Aseguramiento de Calidad (3)
- Dispositivos Médicos (3)
- DMSys (2)
- EESys (7)
- Estudios de Estabilidad de Medicamentos (13)
- Grupo DESISA (1)
- Industria Farmacéutica en México (10)
- Mantenimiento del Estado Validado (1)
- RAPSys (10)
- Revisión Anual de Producto (24)
- Sistemas Computarizados en la Farmacéutica (6)
- Validación de Sistemas Computarizados (5)
- Verificación continua del Proceso (6)



