Cálculos para periodo de reanálisis o vida útil de fármacos y medicamentos
El objetivo de un estudio de estabilidad es conocer que tan estable se mantiene un medicamento en condiciones ambientales definidas, con base en el análisis de mínimo tres lotes del fármaco o medicamento. Por otro lado, también establecer con fundamento estadístico un período de reanálisis o de vida útil, así como conocer las condiciones de almacenamiento indicadas en la etiqueta que aplicarán a los lotes futuros fabricados y envasados en circunstancias similares.
La guía ICH Q1 indica que el análisis de regresión es un enfoque adecuado para el análisis cuantitativo de los datos de estabilidad para determinar el periodo de reanálisis o de vida útil y recomienda que se realice una prueba estadística para conjuntar datos (Poolability).
Antes de combinar los datos de varios lotes para estimar un período de reanálisis o de vida útil, se debe realizar una prueba estadística preliminar para determinar si las líneas de regresión de diferentes lotes tienen una pendiente común y un intercepto común al tiempo cero. El análisis de covarianza (ANCOVA) se puede utilizar para probar las diferencias en las pendientes y las intersecciones de las líneas de regresión entre los lotes del estudio de estabilidad.
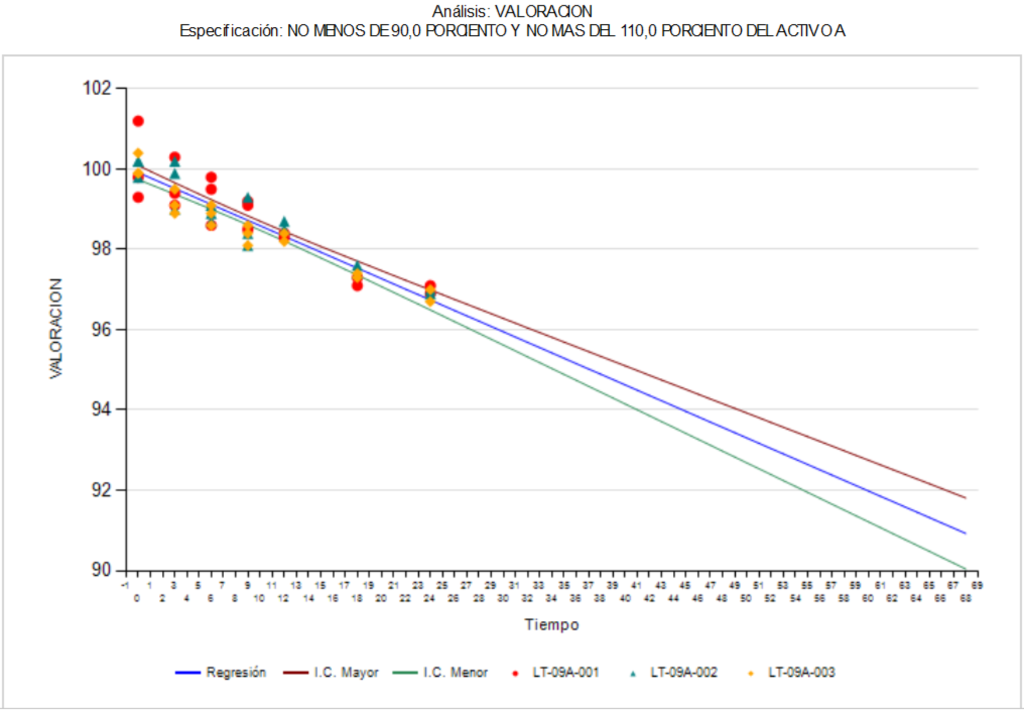
Un enfoque adecuado para calcular el periodo de reanálisis o la vida útil es analizar un atributo cuantitativo (por ejemplo, valoración y/o productos de degradación) mediante la determinación del tiempo en el cual el límite de confianza (alfa) de 95 por ciento cruza con el criterio de aceptación propuesto o límite de especificación.
Esta metodología es conocida como “Banda de Confianza” y está incluida en el software EESys© V2 para la administración, control y estadística de los estudios de estabilidad.
La misma guía ICH Q1 indica que “se debe adoptar un método sistemático en la presentación y la evaluación de la información de estabilidad”, así que implementar un software como EESys© V2 es un paso adelante del cumplimiento regulatorio que facilita el trabajo administrativo y estadístico.
Temas
- Aseguramiento de Calidad (3)
- Dispositivos Médicos (3)
- DMSys (2)
- EESys (8)
- Estudios de Estabilidad de Medicamentos (20)
- Grupo DESISA (1)
- Industria Farmacéutica en México (10)
- Mantenimiento del Estado Validado (1)
- RAPSys (11)
- Revisión Anual de Producto (30)
- Sistemas Computarizados en la Farmacéutica (6)
- Validación de Sistemas Computarizados (5)
- Verificación continua del Proceso (6)

Deja un comentario