7 Errores Comunes en Estudios de Estabilidad y Cómo los Sistemas Informáticos Pueden Prevenirlos

En la industria farmacéutica, los estudios de estabilidad son fundamentales para garantizar la seguridad y eficacia de los productos farmacéuticos a lo largo de su vida útil. Sin embargo, la gestión manual de estos estudios puede conducir a errores significativos que afectan la integridad de los datos y, en última instancia, la conformidad regulatoria. A continuación, exploramos los errores más comunes encontrados en las auditorías de estudios de estabilidad y cómo la implementación de sistemas informáticos puede ayudar a prevenirlos.
Los 8 Hallazgos y Observaciones Frecuentes de Auditorías en la Revisión Anual de Producto

La Revisión Anual de Producto (RAP) o Revisión Periódica de Calidad no es solo una obligación regulatoria; es un pilar fundamental para la mejora continua de la calidad y la seguridad de los productos farmacéuticos. Para evitar los hallazgos y observaciones frecuentes en una auditoría regulatoria, es crucial considerar los siguientes aspectos que nos permitan mejorar la RAP en la industria farmacéutica y ayudar especialmente a gerentes y directores de calidad a prevenir no conformidades e impulsar a la reflexión y acción en torno a las prácticas actuales.
Los hallazgos y observaciones frecuentes en las auditorías regulatorias son los siguientes:
Importancia de la Revisión Anual de Producto: Enfoque Multidisciplinario

En el dinámico y riguroso mundo de la industria farmacéutica, la Revisión Anual de Producto (RAP) se erige como un pilar crítico para garantizar la calidad, eficacia y seguridad de los productos farmacéuticos. Este proceso integral no solo cumple con un requisito regulatorio, sino que también proporciona una oportunidad invaluable para la mejora continua. En este artículo, exploraremos la relevancia de la RAP desde la perspectiva de cuatro áreas clave: Producción, Control de Calidad, Aseguramiento de Calidad y Validación.
Identificación de OOT en Estudios de Estabilidad: Método del Intervalo de Predicción
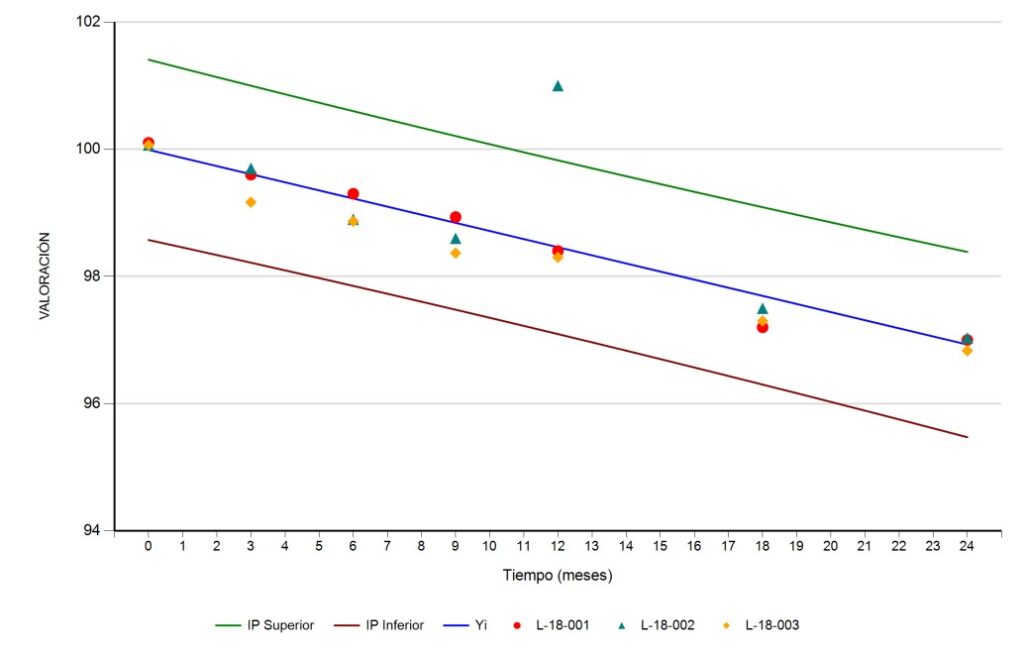
En el competitivo campo de la farmacéutica, la identificación precisa de resultados fuera de tendencia (OOT) en estudios de estabilidad farmacéutica es esencial para la seguridad y eficacia de los medicamentos. El método del intervalo de predicción emerge como una herramienta estadística destacada, combinando precisión y efectividad.
Farmacovigilancia y Compromisos Post-Mercadeo en la Revisión Anual de Producto

La revisión anual de producto (RAP) es una práctica regulada y esencial en la industria farmacéutica para asegurar que los medicamentos mantengan un perfil de calidad, seguridad y eficacia a lo largo del tiempo. Sin embargo, este proceso no ocurre en aislamiento; está profundamente relacionado con otros aspectos regulatorios como la farmacovigilancia y los compromisos post-mercadeo. Este artículo explorará cómo estos elementos interactúan y se complementan en el marco de una revisión anual efectiva del producto.
La NOM-241-SSA1-2021 para Dispositivos Médicos: Vigente

El mundo de los dispositivos médicos se prepara para un hito significativo: la implementación de la NOM-241-SSA1-2021, la cual entró en vigencia a partir del 20 de junio de 2023, después de 18 meses desde su publicación. Esta norma representa un avance significativo en la regulación y supervisión de dispositivos médicos en México, enfatizando la importancia de la revisión anual del producto. Veamos cómo este cambio afectará a la industria y qué significado tiene para los fabricantes y proveedores de dispositivos médicos.
Adaptación de la Revisión Periódica de la Calidad a las Nuevas Realidades de la Industria Farmacéutica

El sector farmacéutico se enfrenta a cambios constantes y evoluciona rápidamente, impulsado por los avances tecnológicos, los cambios en las regulaciones y las nuevas demandas de los pacientes. En este contexto, es esencial que la revisión periódica de la calidad se adapte a estas nuevas realidades. Este artículo examina cómo el proceso de revisión de calidad se está adaptando a las cambiantes dinámicas de la industria farmacéutica.
Evitando No Conformidades en Salida de Muestras

Los estudios de estabilidad son un componente crucial en la industria farmacéutica, asegurándose de que los productos mantengan su eficacia y seguridad durante su vida útil. Uno de los aspectos más significativos de estos estudios implica la salida de muestras de las cámaras climáticas. Este proceso puede ser complejo y, sin el seguimiento adecuado, puede resultar en observaciones durante las auditorías. Pero, ¿cómo se puede simplificar este proceso y minimizar el riesgo de no conformidades? La respuesta puede estar en las notificaciones automáticas de un software adecuado.
Control Estadístico de Proceso (CEP): Nueva herramienta de Monitoreo de Proceso en RAPSys© V2
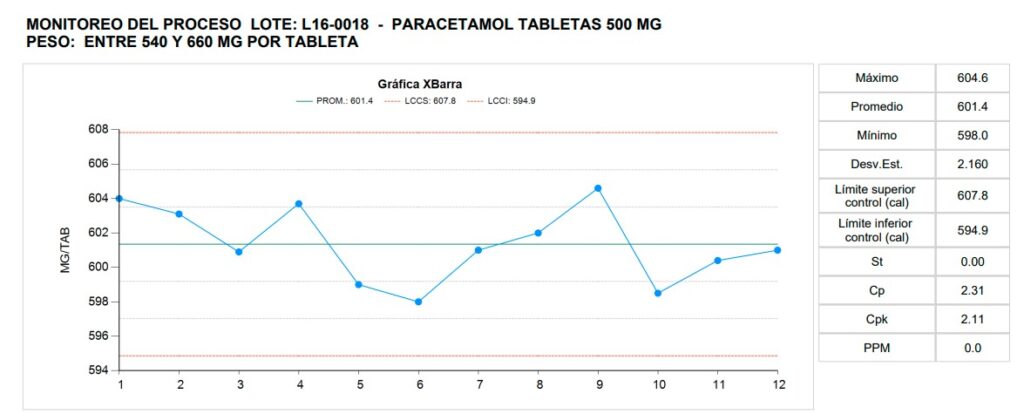
El Control Estadístico de Proceso (CEP) es una herramienta clave en la industria farmacéutica para asegurar la calidad y eficiencia de los procesos de producción. El CEP permite un monitoreo de proceso efectivo mediante el uso de estadísticas y análisis de datos. En este artículo, exploraremos la importancia del CEP, cómo se aplica en la industria farmacéutica y sus ventajas en el monitoreo de proceso.
Mantenimiento del Estado Validado Farmacéutico

El mantenimiento del estado validado de las instalaciones, equipos y sistemas es fundamental para garantizar la confiabilidad y soporte operativo de los procesos productivos en la industria farmacéutica. Consiste en un seguimiento continuo de ciertos elementos de control, y su pérdida puede tener implicaciones graves, como baja productividad, contaminación, destrucción de medicamentos, entre otros.
Temas
- Aseguramiento de Calidad (3)
- Dispositivos Médicos (3)
- DMSys (2)
- EESys (7)
- Estudios de Estabilidad de Medicamentos (13)
- Grupo DESISA (1)
- Industria Farmacéutica en México (10)
- Mantenimiento del Estado Validado (1)
- RAPSys (10)
- Revisión Anual de Producto (24)
- Sistemas Computarizados en la Farmacéutica (6)
- Validación de Sistemas Computarizados (5)
- Verificación continua del Proceso (6)
