Estudios de estabilidad farmacéutica: prevenir desviaciones y fortalecer el cumplimiento

Los estudios de estabilidad farmacéutica no solo determinan la vida útil de un producto. Son el respaldo científico que sostiene decisiones regulatorias, extensiones de caducidad y estrategias de reducción de análisis. Para un gerente de Control de Calidad o un especialista en estabilidad, el desafío no es ejecutar los análisis programados, sino asegurar que el sistema completo opere con trazabilidad, coherencia documental y control estadístico continuo.
Fallas en estudios de estabilidad provocan clausura de laboratorios
En octubre de 2025, la industria farmacéutica argentina se vio sacudida por un nuevo episodio de clausuras preventivas y retiro de medicamentos. La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) ordenó el cierre temporal de Laboratorios Beta S.A., fabricante del medicamento Exotran (mesalazina de liberación prolongada), tras constatar graves irregularidades en sus procesos productivos y en la gestión de los estudios de estabilidad. El Instituto Nacional de Medicamentos (INAME), órgano de fiscalización de ANMAT, reveló que las fallas abarcaron tanto la administración de la calidad como la consistencia de los ensayos, evidenciando una problemática que puede repetirse en otros laboratorios si no se toman medidas preventivas.
Tiempo de análisis post‑extracción en los estudios de estabilidad: crucial

En los estudios de estabilidad farmacéutica, el tiempo que transcurre desde que las muestras salen de la cámara climática hasta que son analizadas en laboratorio es un factor crítico. Una demora excesiva puede comprometer la validez del estudio y poner en riesgo la calidad y seguridad del producto.
Auditorías internas en estudios de estabilidad: guía básica para cumplir con COFEPRIS, INVIMA y FDA

Para que los estudios de estabilidad sean válidos ante organismos reguladores como COFEPRIS, FDA o INVIMA, no basta con realizarlos: deben estar perfectamente documentados, trazables y auditables. Por ello, las auditorías internas juegan un papel clave en el cumplimiento normativo.
En este artículo te compartimos una guía práctica para realizar auditorías internas efectivas en estudios de estabilidad, enfocadas a prevenir observaciones regulatorias y fortalecer tus procesos.
Gestión del Inventario de Muestras en Estudios de Estabilidad

La gestión del inventario de muestras en estudios de estabilidad es un componente crítico en la industria farmacéutica. Un error en la trazabilidad de las muestras puede generar retrasos, desviaciones regulatorias e incluso la repetición de estudios completos, lo que significa pérdida de tiempo y dinero. ¿La clave? Un sistema eficiente, automatizado y en cumplimiento con normativas como ICH Q1A y FDA 21 CFR Part 11.
La Importancia de los Controles en los Estudios de Estabilidad Farmacéutica

En la industria farmacéutica, los estudios de estabilidad son una parte esencial del ciclo de vida de un producto, ya que permiten a los fabricantes entender cómo factores como el tiempo, la temperatura, la humedad y la luz afectan la composición y el desempeño de los productos farmacéuticos. Sin embargo, es crucial implementar controles rigurosos que permitan monitorear su desarrollo de manera precisa.
Análisis Oportuno de Muestras de Estabilidad según la NOM-073-SSA1-2015

En la industria farmacéutica, la estabilidad de los productos es un aspecto crítico que garantiza la seguridad y eficacia de los medicamentos a lo largo de su vida útil. La Norma Oficial Mexicana NOM-073-SSA1-2015 establece directrices claras para asegurar que los análisis de estabilidad se realicen de manera adecuada y oportuna. En particular, el punto 10.17 de esta norma indica que “El análisis de las muestras de estabilidad deberá llevarse a cabo durante los 30 días siguientes al retiro de las mismas de las condiciones de estabilidad correspondiente”. Este artículo explora la importancia de este requisito y su impacto en la calidad del producto final.
7 Errores Comunes en Estudios de Estabilidad y Cómo los Sistemas Informáticos Pueden Prevenirlos

En la industria farmacéutica, los estudios de estabilidad son fundamentales para garantizar la seguridad y eficacia de los productos farmacéuticos a lo largo de su vida útil. Sin embargo, la gestión manual de estos estudios puede conducir a errores significativos que afectan la integridad de los datos y, en última instancia, la conformidad regulatoria. A continuación, exploramos los errores más comunes encontrados en las auditorías de estudios de estabilidad y cómo la implementación de sistemas informáticos puede ayudar a prevenirlos.
Identificación de OOT en Estudios de Estabilidad: Método del Intervalo de Predicción
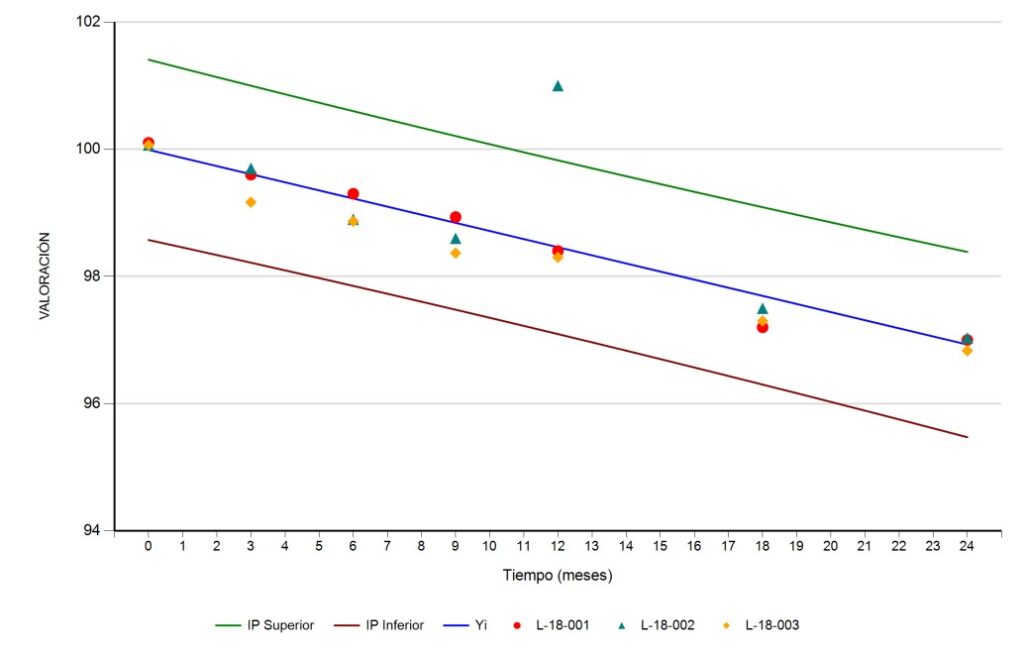
En el competitivo campo de la farmacéutica, la identificación precisa de resultados fuera de tendencia (OOT) en estudios de estabilidad farmacéutica es esencial para la seguridad y eficacia de los medicamentos. El método del intervalo de predicción emerge como una herramienta estadística destacada, combinando precisión y efectividad.
Evitando No Conformidades en Salida de Muestras

Los estudios de estabilidad son un componente crucial en la industria farmacéutica, asegurándose de que los productos mantengan su eficacia y seguridad durante su vida útil. Uno de los aspectos más significativos de estos estudios implica la salida de muestras de las cámaras climáticas. Este proceso puede ser complejo y, sin el seguimiento adecuado, puede resultar en observaciones durante las auditorías. Pero, ¿cómo se puede simplificar este proceso y minimizar el riesgo de no conformidades? La respuesta puede estar en las notificaciones automáticas de un software adecuado.
Temas
- Aseguramiento de Calidad (3)
- Dispositivos Médicos (3)
- DMSys (2)
- EESys (8)
- Estudios de Estabilidad de Medicamentos (20)
- Grupo DESISA (1)
- Industria Farmacéutica en México (10)
- Mantenimiento del Estado Validado (1)
- RAPSys (11)
- Revisión Anual de Producto (30)
- Sistemas Computarizados en la Farmacéutica (6)
- Validación de Sistemas Computarizados (5)
- Verificación continua del Proceso (6)
