Beneficios adicionales de sistematizar la RAP
La elaboración de la revisión anual de producto (RAP) es un requisito normativo obligatorio para las empresas farmacéuticas y sin duda se puede obtener información valiosa cuando se realiza sistemáticamente, además hay beneficios adicionales poco explotados que deberían de tomarse en cuenta para al ahorro de recursos en la industria farmacéutica.
Reducción de análisis basados en la revisión anual de producto
En los análisis de laboratorio para productos importados, así como para los fármacos y aditivos adquiridos podemos encontrar una oportunidad de ahorro en la industria farmacéutica y reducir la carga de trabajo en sus laboratorios. En la revisión anual de producto (RAP) y una estadística adecuada podríamos tener la combinación perfecta para solicitar a la autoridad regulatoria pertinente la reducción de los análisis.
¿Porque adquirir un software para sistematizar la RAP?
Sin duda alguna el realizar la Revisión Anual de Producto es una tarea complicada que requiere de cierta disciplina, organización, trabajo en equipo, liderazgo y un sistema que administre la información proporcionando las herramientas para hacer que todo este proceso sea mas sencillo.
Alianza de autoridades sanitarias INVIMA, ISP y COFEPRIS
COFEPRIS (México), INVIMA (Colombia) e ISP (Chile) avanzan en temas de regulación farmacéutica firmando una alianza.
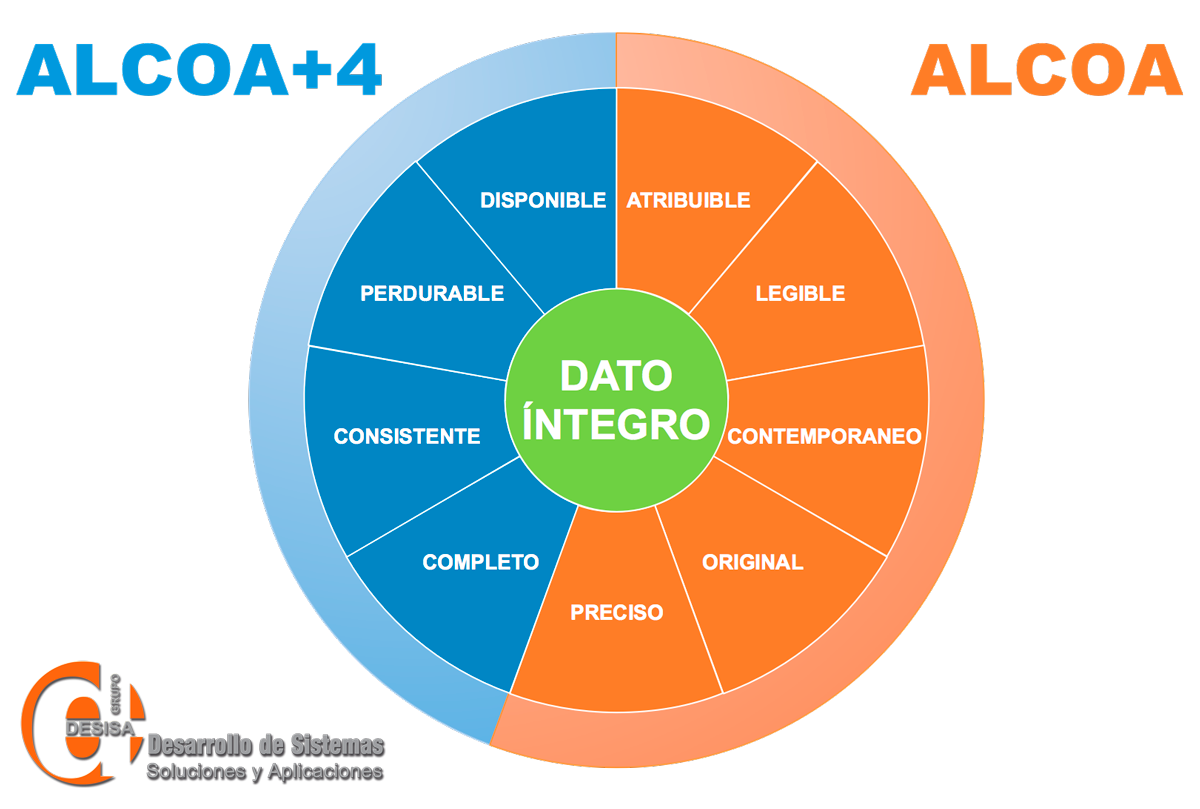
La integridad de datos en la industria farmacéutica
Las empresas farmacéuticas reciben regularmente auditorías de calidad por parte de las agencias regulatorias, como la COFEPRIS en México. Generalmente los auditores revisan cada etapa del proceso productivo, desde la recepción de materias primas hasta la comercialización del producto terminado.
El nuevo formato normativo para la revisión anual de producto
En las normas anteriores a la 2015, la información se presentaba más por la interpretación de cada punto normativo. Hoy con el nuevo formato dicha interpretación se convierte en una solicitud concreta de información. El apéndice B normativo es un formato establecido que no deja duda en cuanto a las secciones que le componen. Quizá habrá quienes quieran mostrar más allá de la información requerida, sin embargo no podrá ser menos de lo ahí especificado. Adicional a esto, cada persona o departamento se hace responsable de la información que genera firmando la sección del apéndice que le corresponde.
Implementando un sistema para la revisión anual de producto
Para asegurar una puesta en marcha exitosa de un software en la industria farmacéutica debe existir un procedimiento comprobado, que garantizará que la implementación se realice en tiempo y forma.
RAPSys© V2 ahora funciona con SQL Server
Debido a la necesidad de crecimiento y al impulso de mejora que los clientes de la industria farmacéutica requieren, ahora el sistema RAPSys© V2 puede almacenar la información en una base de datos más robusta, la base de datos de Microsoft® SQL Server.
COFEPRIS clausura empresa farmacéutica
El pasado mes de septiembre la Comisión Federal para la Protección contra Riesgos Sanitarios COFEPRIS clausuró planta farmacéutica en el estado de Jalisco debido a algunas irregularidades en la información de sus medicamentos.
Desviaciones Comunes en Estudios de Estabilidad de Medicamentos
oca
Las desviaciones más comunes en los estudios de estabilidad de medicamentos pueden evitarse utilizando las herramientas adecuadas. Hay desviaciones desde el punto de vista analítico como: incumplimiento de las especificaciones establecidas, material de envase incompatible, fallos en las cámaras climáticas. También existen otras desviaciones administrativas menos severas pero que de igual forma impactan a los estudios de estabilidad
Temas
- Aseguramiento de Calidad (3)
- Dispositivos Médicos (3)
- DMSys (2)
- EESys (8)
- Estudios de Estabilidad de Medicamentos (20)
- Grupo DESISA (1)
- Industria Farmacéutica en México (10)
- Mantenimiento del Estado Validado (1)
- RAPSys (11)
- Revisión Anual de Producto (30)
- Sistemas Computarizados en la Farmacéutica (6)
- Validación de Sistemas Computarizados (5)
- Verificación continua del Proceso (6)