Combinabilidad de los datos en estudios de estabilidad (Poolability)
Uno de los objetivos del análisis estadístico en los estudios de estabilidad es evaluar si el periodo de reanálisis o vida útil estimado es más largo que el propuesto. Saber si podemos o no combinar los datos de los lotes en la estadística es de vital importancia.
Función de la RAP en la verificación continua de la calidad
La verificación continua de la calidad es una metodología creciente en la industria farmacéutica, en este artículo veremos que la realización de una RAP eficaz y eficiente puede ayudar en la implementación de dicha metodología.
Soporte técnico especializado – importancia de contar con ello
Es importante conocer el porque es ampliamente recomendable contar con soporte técnico especializado de los sistemas de cómputo instalados en nuestra empresa (Industria farmacéutica) para explicarlo de una manera sencilla, haremos una analogía con los seguros de auto, se dice que “Es mejor tenerlo y no necesitarlo… que no tenerlo y lamentablemente necesitarlo”, es por ello que consideramos de vital importancia en la industria farmacéutica, conocer y contar con un “seguro” de soporte especializado, al cual se le denomina “Póliza de soporte técnico especializado”.
Oportunidades de Mejora en la RAP detectadas por COFEPRIS
En cursos impartidos recientemente por la autoridad sanitaria COFEPRIS en México, se han revelado las oportunidades de mejora más frecuentes encontradas en la revisión anual de producto durante las auditorías a empresas farmacéuticas.
Beneficios adicionales de sistematizar la RAP
La elaboración de la revisión anual de producto (RAP) es un requisito normativo obligatorio para las empresas farmacéuticas y sin duda se puede obtener información valiosa cuando se realiza sistemáticamente, además hay beneficios adicionales poco explotados que deberían de tomarse en cuenta para al ahorro de recursos en la industria farmacéutica.
Reducción de análisis basados en la revisión anual de producto
En los análisis de laboratorio para productos importados, así como para los fármacos y aditivos adquiridos podemos encontrar una oportunidad de ahorro en la industria farmacéutica y reducir la carga de trabajo en sus laboratorios. En la revisión anual de producto (RAP) y una estadística adecuada podríamos tener la combinación perfecta para solicitar a la autoridad regulatoria pertinente la reducción de los análisis.
¿Porque adquirir un software para sistematizar la RAP?
Sin duda alguna el realizar la Revisión Anual de Producto es una tarea complicada que requiere de cierta disciplina, organización, trabajo en equipo, liderazgo y un sistema que administre la información proporcionando las herramientas para hacer que todo este proceso sea mas sencillo.
Alianza de autoridades sanitarias INVIMA, ISP y COFEPRIS
COFEPRIS (México), INVIMA (Colombia) e ISP (Chile) avanzan en temas de regulación farmacéutica firmando una alianza.
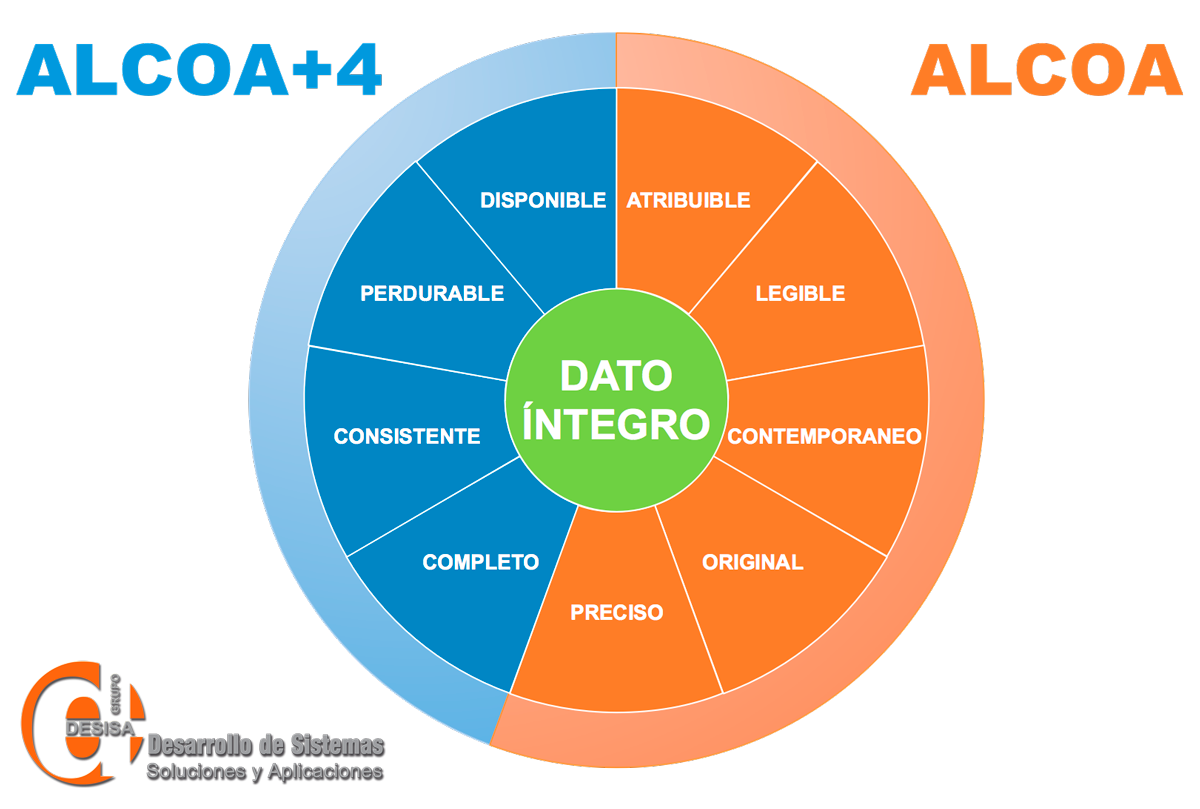
La integridad de datos en la industria farmacéutica
Las empresas farmacéuticas reciben regularmente auditorías de calidad por parte de las agencias regulatorias, como la COFEPRIS en México. Generalmente los auditores revisan cada etapa del proceso productivo, desde la recepción de materias primas hasta la comercialización del producto terminado.
El nuevo formato normativo para la revisión anual de producto
En las normas anteriores a la 2015, la información se presentaba más por la interpretación de cada punto normativo. Hoy con el nuevo formato dicha interpretación se convierte en una solicitud concreta de información. El apéndice B normativo es un formato establecido que no deja duda en cuanto a las secciones que le componen. Quizá habrá quienes quieran mostrar más allá de la información requerida, sin embargo no podrá ser menos de lo ahí especificado. Adicional a esto, cada persona o departamento se hace responsable de la información que genera firmando la sección del apéndice que le corresponde.
Temas
- Aseguramiento de Calidad (3)
- Dispositivos Médicos (3)
- DMSys (2)
- EESys (8)
- Estudios de Estabilidad de Medicamentos (20)
- Grupo DESISA (1)
- Industria Farmacéutica en México (10)
- Mantenimiento del Estado Validado (1)
- RAPSys (11)
- Revisión Anual de Producto (30)
- Sistemas Computarizados en la Farmacéutica (6)
- Validación de Sistemas Computarizados (5)
- Verificación continua del Proceso (6)