Adaptación de la Revisión Periódica de la Calidad a las Nuevas Realidades de la Industria Farmacéutica

El sector farmacéutico se enfrenta a cambios constantes y evoluciona rápidamente, impulsado por los avances tecnológicos, los cambios en las regulaciones y las nuevas demandas de los pacientes. En este contexto, es esencial que la revisión periódica de la calidad se adapte a estas nuevas realidades. Este artículo examina cómo el proceso de revisión de calidad se está adaptando a las cambiantes dinámicas de la industria farmacéutica.
Evitando No Conformidades en Salida de Muestras

Los estudios de estabilidad son un componente crucial en la industria farmacéutica, asegurándose de que los productos mantengan su eficacia y seguridad durante su vida útil. Uno de los aspectos más significativos de estos estudios implica la salida de muestras de las cámaras climáticas. Este proceso puede ser complejo y, sin el seguimiento adecuado, puede resultar en observaciones durante las auditorías. Pero, ¿cómo se puede simplificar este proceso y minimizar el riesgo de no conformidades? La respuesta puede estar en las notificaciones automáticas de un software adecuado.
Control Estadístico de Proceso (CEP): Nueva herramienta de Monitoreo de Proceso en RAPSys© V2
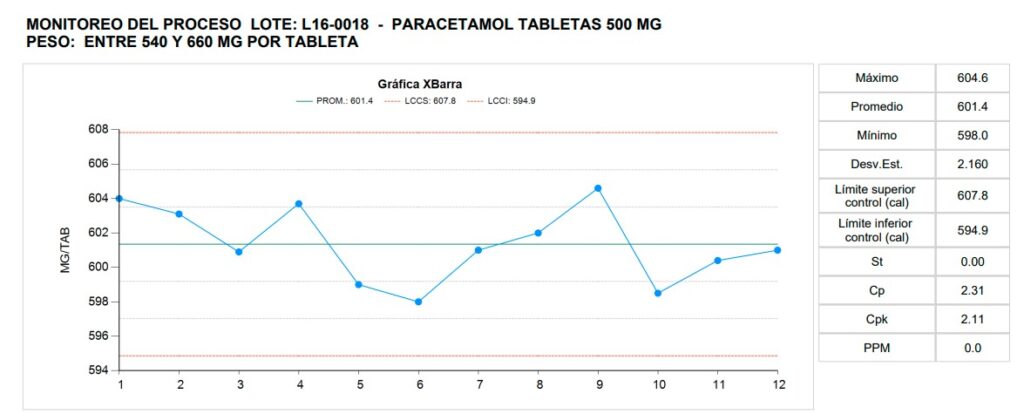
El Control Estadístico de Proceso (CEP) es una herramienta clave en la industria farmacéutica para asegurar la calidad y eficiencia de los procesos de producción. El CEP permite un monitoreo de proceso efectivo mediante el uso de estadísticas y análisis de datos. En este artículo, exploraremos la importancia del CEP, cómo se aplica en la industria farmacéutica y sus ventajas en el monitoreo de proceso.
Mantenimiento del Estado Validado Farmacéutico

El mantenimiento del estado validado de las instalaciones, equipos y sistemas es fundamental para garantizar la confiabilidad y soporte operativo de los procesos productivos en la industria farmacéutica. Consiste en un seguimiento continuo de ciertos elementos de control, y su pérdida puede tener implicaciones graves, como baja productividad, contaminación, destrucción de medicamentos, entre otros.
Análisis de tendencias, cruciales en los estudios de estabilidad
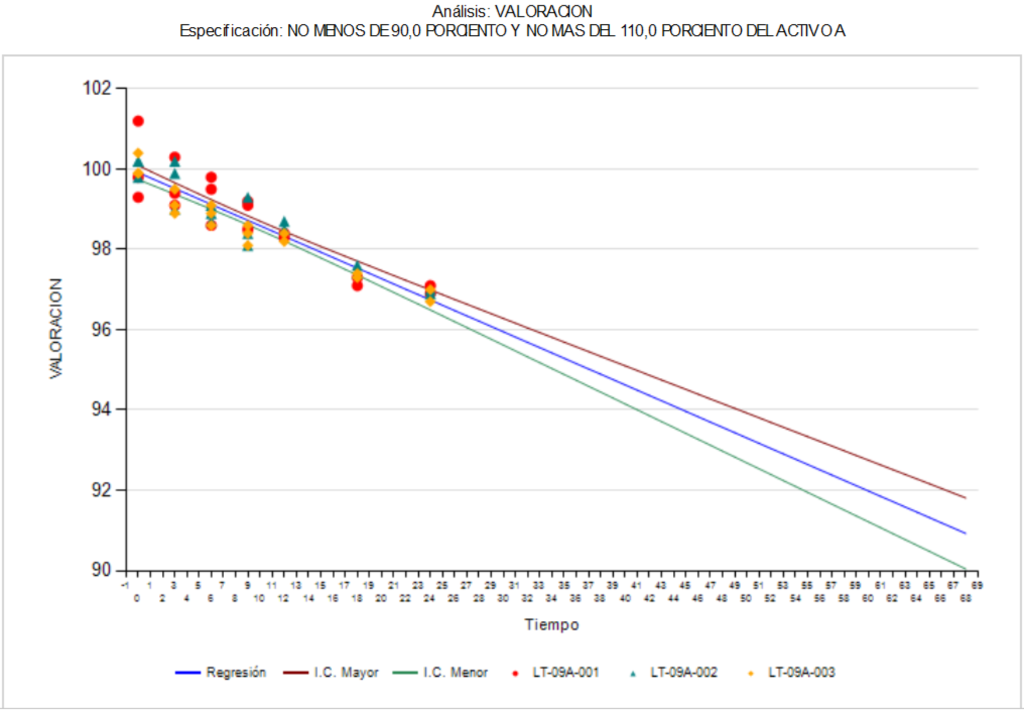
En la industria farmacéutica, el estudio de estabilidad de medicamentos es un proceso esencial para asegurar la calidad, seguridad y eficacia de los productos farmacéuticos. Los estudios de estabilidad se realizan para evaluar cómo cambia la calidad de los medicamentos con el tiempo, en diferentes condiciones de almacenamiento y transporte. Sin embargo, en la actualidad, la importancia de realizar análisis de tendencias en los estudios de estabilidad de medicamentos está tomando cada vez más relevancia, sobre todo para las agencias regulatorias.
Integración de la etapa 3 de validación con la RAP

La integración de la etapa 3 de validación con la revisión anual de producto es esencial en la industria farmacéutica para garantizar la calidad y la seguridad de los productos. Al combinar estos dos procesos, se pueden identificar y resolver problemas de manera rápida y eficiente, lo que garantiza que los productos cumplen con los estándares necesarios.
Cambio de Imagen Corporativa Grupo DESISA

Iniciamos el 2023 y deseamos que nuestros clientes y amigos tenga un excelente año, logrando metas y alcanzando los resultados esperados. En Grupo DESISA, valoramos el cuidado de los detalles en todo lo que hacemos. Nuestro compromiso con la calidad se refleja en nuestro cambio de imagen corporativa que proyecta compromiso, modernidad y un enfoque en la mejora continua.
Análisis Estadístico para la RAP
En esta cápsula informativa hablaremos que estadísticas son las más comunes y porque se usan para el análisis de los datos estadísticos en la revisión anual de producto.
Alcance y objetivos de un software para la RAP y validación etapa 3

¿PARA QUE FUE DISEÑADO?
RAPSys© V2 es un software que permite realizar sistemáticamente los procesos de Revisión Anual de Producto y Validación Etapa 3 (Verificación continua del proceso) en la Industria Farmacéutica y Farmoquímica.
Modifica la percepción de que el resultado del proceso se analiza “al final de…”, por “durante de…” lo que proporcionará toma de decisiones preventivas, evitando correctivas…
Lanzamiento DMSys© software de revisión anual de producto para Dispositivos Médicos

El día de hoy lunes 12 de septiembre de 2022 nos complace informar el lanzamiento oficial del nuevo DMSys©, un software para la revisión anual de producto en la industria de dispositivos médicos, que fue desarrollado en base en los requerimientos de la NOM-241-SSA1-2021 y estándares internacionales para realizar la revisión anual de producto.
Temas
- Aseguramiento de Calidad (3)
- Dispositivos Médicos (3)
- DMSys (2)
- EESys (8)
- Estudios de Estabilidad de Medicamentos (20)
- Grupo DESISA (1)
- Industria Farmacéutica en México (10)
- Mantenimiento del Estado Validado (1)
- RAPSys (11)
- Revisión Anual de Producto (30)
- Sistemas Computarizados en la Farmacéutica (6)
- Validación de Sistemas Computarizados (5)
- Verificación continua del Proceso (6)
